Thực hiện chẩn đoán bệnh đầu vàng ở tôm sú giống bằng phương pháp RT PCR như thế nào? Cần phải lấy bao nhiêu cá thể trong đàn tôm để tiến hành chẩn đoán bệnh ở tôm sú giống?
Có thể chẩn đoán lâm sàng về tình trạng sức khỏe của tôm có mắc bệnh đầu vàng hay thông qua những đặc điểm nào?
Theo Mục 5 TCVN 8710-4:2019 về Bệnh thủy sản - Quy trình chẩn đoán - Phần 4: Bệnh đầu vàng ở tôm quy định về triệu chứng lâm sàng của tôn khi mắc bệnh đầu vàng như sau:
"5 Chẩn đoán lâm sàng
5.1 Đặc điểm dịch tễ
Những loài tôm mẫn cảm với vi rút đầu vàng (YHV1) gồm tôm sú (Penaeus monodon), tôm thẻ chân trắng (P. vannamei) và một số loại tôm khác.
Tôm sú mẫn cảm với YHV1 từ giai đoạn hậu ấu trùng (PL15). Các loài tôm khác có thể nhiễm bệnh ở các giai đoạn khác nhau nhưng thường xảy ra ở giai đoạn từ 40 ngày đến 70 ngày tuổi. Tỉ lệ chết có thể đến 100% trong vòng từ 3 ngày đến 5 ngày kể từ khi quan sát thấy dấu hiệu bệnh lý.
Vi rút đầu vàng (YHV1) có thể lây truyền theo chiều ngang từ thức ăn nhiễm vi rút, tôm nhiễm bệnh bài tiết vi rút ra môi trường hoặc một số tôm tự nhiên nhiễm YHV1 lây truyền cho các tôm trong ao nuôi. Những cá thể nhiễm bệnh mạn tính có thể truyền vi rút sang con cháu qua đường sinh sản.
5.2 Triệu chứng lâm sàng
Tôm ăn nhiều bất thường rồi đột ngột ngừng ăn và chết sau 2 ngày đến 4 ngày. Tỷ lệ chết có thể lên đến 100% sau 3 ngày đến 5 ngày nhiễm bệnh.
Tôm bị bệnh tập trung ở rìa ao hoặc gần mặt nước, toàn than màu nhợt nhạt.
Phần giáp đầu ngực có màu vàng và toàn thân nhợt nhạt.
5.3 Bệnh tích
Mang chuyển màu trắng, vàng hoặc nâu.
Gan tụy sưng và chuyển màu vàng.
Trong một số trường hợp tôm không xuất hiện dấu hiệu bệnh lí nhưng quan sát các tế bào gan tụy, tế bào máu, cơ quan lympho, ruột, mang, tuyến anten, mô liên kết thấy các thể vùi trong tế bào chất, nhân tế bào co rúm hoặc vỡ thành nhiều mảnh."
Theo đó, chủ trang trại nuôi tôm sú giống có thể tự chẩn đoán lâm sàng tình trạng của tôm sú giống thông quan các triệu chứng lâm sàng như tôm sẽ ăn nhiều bất thường rồi đột ngột ngừng ăn và chết sau 2 đến 4 ngày. Tôm bị bệnh tập trung ở rìa ao hoặc gần mặt nước, toàn than màu nhợt nhạt và hần giáp đầu ngực có màu vàng và toàn thân nhợt nhạt.
Hoặc nếu có thiết bị hỗ trợ có thể chủ trang trại có thể kiểm tra bằng cách quan sát các tế bào gan tụy, tế bào máu, cơ quan lympho, ruột, mang, tuyến anten, mô liên kết; khi thấy các thể vùi trong tế bào chất, nhân tế bào co rúm hoặc vỡ thành nhiều mảnh thì tôm đã mắc bệnh đầu vàng.

Thực hiện chẩn đoán bệnh đầu vàng ở tôm sú giống bằng phương pháp RT PCR như thế nào? (Nguồn ảnh: Internet)
Cần phải lấy bao nhiêu cá thể trong đàn tôm để tiến hành chẩn đoán bệnh ở tôm sú giống?
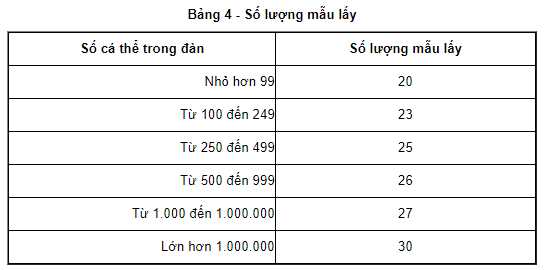
Theo tiểu mục 3.3 Mục 3 QCVN 02-34-1:2021/BNNPTNT về Giống tôm nước lợ, tôm biển - Phần 1: Tôm sú, tôm thẻ chân trắng quy định về số lượng mẫu thử phải lấy khi muốn tiến hành thử nghiệm tác nhân gây bệnh ở tôm như sau:
"3. PHƯƠNG PHÁP THỬ
...
3.3.1. Số lượng mẫu lấy để kiểm tra tác nhân gây bệnh được quy định trong Bảng 4:
..."
Như vậy tùy vào số lượng cá thể tôm sú giống trong trại nuôi mà chủ trang trại sẽ tiến hành lấy số lượng mẫu để chẩn đoán bệnh tương ứng với số liệu theo quy định tại bảng trên.
Thực hiện chẩn đoán bệnh đầu vàng ở tôm sú giống bằng phương pháp RT PCR như thế nào?
Theo tiểu mục 6.1 Mục 6 TCVN 8710-4:2019 về Bệnh thủy sản - Quy trình chẩn đoán - Phần 4: Bệnh đầu vàng ở tôm quy định về việc chẩn đoán bệnh đầu vàng ở tôm bằng phương pháp RT PCR như sau:
"6 Chẩn đoán trong phòng thí nghiệm
6.1 Phương pháp RT PCR (Reverse Transcription Polymerase Chain Reaction)
6.1.1 Lấy mẫu
Số lượng tôm trên mỗi mẫu phụ thuộc vào kích cỡ của tôm:
- Giai đoạn ấu trùng, hậu ấu trùng: 100 mg
- Tôm trưởng thành, tôm bố mẹ: lấy từ 5 con/mẫu đến 10 con/mẫu.
CHÚ THÍCH: Lấy tôm còn sống, sắp chết hoặc mới chết có biểu hiện bệnh lý.
6.1.2 Bảo quản mẫu
Trong quá trình vận chuyển, mẫu được bảo quản ở nhiệt độ từ 2 °C đến 8 °C không quá 48 h hoặc bảo quản trong etanol từ 96 % đến 100 % (3.1.1).
Mẫu chuyển đến phòng thí nghiệm nếu chưa phân tích ngay phải được bảo quản ở nhiệt độ âm 20 °C đến âm 80 °C hoặc trong etanol từ 96 % đến 100 % (3.1.1).
6.1.3 Chuẩn bị mẫu
Giai đoạn ấu trùng, hậu ấu trùng: Sử dụng nguyên con.
Tôm trưởng thành: Lấy mang, máu, gan tụy.
Lượng mẫu cần chuẩn bị: Khoảng 30 mg.
Mẫu được nghiền nhuyễn với tỷ lệ 1 thể tích mẫu trong 9 thể tích dung dịch muối đệm PBS (3.1.2), để tạo thành huyễn dịch 10 %, chia thành hai phần: một phần cho thực hiện xét nghiệm và một phần lưu trữ ở tủ âm (-80 °C).
6.1.4 Cách tiến hành
6.1.4.1 Tách chiết ARN
Sử dụng bộ kít tách chiết (3.2.3) thích hợp và an toàn theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Sử dụng kit tách chiết ARN: PureLinK Viral RNA/DNA Mini kít (50) (Lot 1361246)[1]) (xem phụ lục B).
6.1.4.2 Chuẩn bị mồi
Phương pháp RT PCR sử dụng cặp mồi đặc hiệu 10F/144R (3.2.1) để phát hiện YHV1. Trình tự cặp mồi (xem phụ lục C, Bảng C1).
Mồi được chuẩn bị như sau:
- Mồi ở trạng thái đông khô phải được ly tâm nhanh bằng máy spindown (4.1.5) trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Dùng dung dịch đệm TE (3.2.6) để hoàn nguyên mồi ở nồng độ 100 µM làm gốc;
- Mồi được sử dụng ở nồng độ 10 µM: Pha loãng mồi gốc bằng nước tinh khiết không có nuclease (3.2.8) (10 µl mồi gốc và 90 µl nước tinh khiết không có nuclease).
6.1.4.3 Thực hiện phản ứng RT - PCR
Phản ứng khuếch đại được thực hiện trong máy PCR (4.1.1) theo phương pháp RT PCR sử dụng cặp mồi đã được chuẩn bị (3.2.1) sử dụng kít nhân gen (3.2.4) theo hướng dẫn của nhà sản xuất (xem phụ lục C).
6.1.4.4 Điện di
6.1.4.4.1 Chuẩn bị bản gel
Pha thạch với nồng độ agarose (3.2.12) từ 1,5 % đến 2 % bằng dung dịch đệm TBE 1X hoặc TAE 1X (3.2.9) vào chai thủy tinh 250 ml, lắc đều rồi đun sôi.
Khi nhiệt độ giảm xuống khoảng 40 °C đến 50 °C thì bổ sung 10 µl chất nhuộm màu (3.2.11) vào mỗi 100 ml thạch. Lắc nhẹ tránh tạo bọt để chất nhuộm màu tan đều.
Tiến hành đổ thạch vào khay điện di đã được cài lược, không nên đổ bản thạch dày quá 0,8 cm
Khi bản thạch đông lại thì tiến hành gỡ lược khỏi bản thạch.
Chuyển bản gel vào bể điện di (4.1.6), đổ dung dịch đệm (TBE 1X hoặc TAE 1X) cùng loại với dung dịch pha thạch agarose đã đun vào bể điện di cho tới khi ngập bản thạch.
CHÚ THÍCH: Có thể dùng các sản phẩm có sẵn chất nhuộm ADN để pha chế thạch agarose (VÍ DỤ: Sybr safe DNA gel stain) và sử dụng theo quy định của nhà sản xuất.
6.1.4.4.2 Chạy điện di
Hút 2 µl chất đệm tải mẫu (Loading dye 6X) (3.2.10) vào 8 µl sản phẩm PCR trộn đều và cho vào các giếng trên bản thạch.
Thực hiện điện di trong bộ điện di (4.1.6), chạy kèm theo thang chuẩn DNA (ladder) (3.2.7) để dự đoán kích thước sản phẩm khuếch đại. Hút 10 µl thang chuẩn ADN (ladder) (3.2.7) vào một giếng trên bản thạch.
Điện di ở hiệu điện thế 100 V trong thời gian 25 min.
6.1.5 Đọc kết quả
Sau khi điện di, đọc kết quả trên máy đọc gel (4.1.7).
Điều kiện phản ứng được công nhận khi:
- Mẫu đối chứng âm không có vạch sáng (không có sản phẩm khuếch đại);
- Mẫu đối chứng dương có vạch sáng kích thước 135 bp.
Với điều kiện phản ứng trên:
Kết quả mẫu thử dương tính khi:
- Tại giếng mẫu thử xuất hiện vạch sáng có kích thước 135 bp.
- Thang chuẩn ADN phân vạch rõ ràng.
Kết quả mẫu thử âm tính khi:
- Tại giếng mẫu thử không xuất hiện vạch sáng.
- Thang chuẩn ADN phân vạch rõ ràng."
Theo đó, việc chẩn đoán bệnh bằng phương pháp RT PCR sẽ được thực hiện ở phòng thí nghiệm; đảm bảo đầy đủ các thiết bị, dụng cụ và các thứ cần thiết khác cho việc thử nghiệm. Quy trình chẩn đoán được thực hiện theo trình tự được quy định nêu trên.
Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.