Chu trình nhiệt để phát hiện virus gây bệnh herpesvirus trên cá chép bằng phương pháp PCR thực hiện ra sao?
- Chẩn đoán bệnh Herpesvirus ở cá chép bằng phương pháp PCR thì cần sử dụng những thiết bị dụng cụ nào?
- Chu trình nhiệt để phát hiện virus gây bệnh herpesvirus trên cá chép bằng phương pháp PCR thực hiện ra sao?
- Thực hiện điện di sản phẩm PCR để chẩn đoán bệnh herpesvirus trên cá chép nhiễm bệnh ra sao?
Chẩn đoán bệnh Herpesvirus ở cá chép bằng phương pháp PCR thì cần sử dụng những thiết bị dụng cụ nào?
Theo Mục 4 Tiêu chuẩn quốc gia TCVN 8710-6:2019 về Bệnh thủy sản - Quy trình chẩn đoán - Phần 6: Bệnh do Koi herpesvirus ở cá chép quy định về thiết bị và dụng cụ dùng trong phương pháp PCR như sau:
"4 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thí nghiệm sinh học thông thường và cụ thể như sau:
4.1 Thiết bị, dụng cụ sử dụng chung
4.1.1 Tủ lạnh: tủ lạnh thường (từ 0 °C đến 8 °C), tủ lạnh âm sâu (từ âm 20 °C đến âm 80 °C);
4.1.2 Buồng cấy an toàn sinh học cấp 2;
4.1.3 Máy lắc trộn vortex, có thể hoạt động với tốc độ từ 200 g đến 2500 g;
4.1.4 Máy nghiền mẫu hoặc cối, chày sứ, kéo, panh kẹp, vô trùng;
4.1.5 Dụng cụ tiêu hao như: găng tay, khẩu trang, bảo hộ cá nhân.
4.2 Thiết bị, dụng cụ cho phương pháp PCR, realtime PCR
4.2.1 Máy nhân gen (PCR, realtime PCR);
4.2.2 Máy ly tâm, có thể thực hiện ở 1500 g đến 2500 g, 10000 g và 12000 g;
4.2.3 Máy lắc ủ nhiệt;
4.2.4 Máy spindown, máy ly tâm lắng;
4.2.5 Máy chiết tách ADN/ARN tự động (nếu có);
4.2.6 Bộ điện di: khay đổ thạch, bể điện di, máy đọc và chụp ảnh gel.
Ngoài ra, còn có các loại đầu tip, pipet, ống nghiệm, đĩa petri và các vật tư tiêu hao phù hợp cho quá trình thực hiện các biện pháp kỹ thuật trong tiêu chuẩn này."
Như vậy, thiết bị và dụng cụ dùng trong phương pháp PCR được chia làm 02 loại, gồm thiết bị, dụng cụ dùng chung và thiết bị, dụng cụ dùng riêng cho phương pháp PCR
Các thiết bị, dụng dùng riêng cho phương pháp PCR gồm:
- Máy nhân gen (PCR);
- Máy ly tâm, có thể thực hiện ở 1500 g đến 2500 g, 10000 g và 12000 g;
- Máy lắc ủ nhiệt;
- Máy spindown, máy ly tâm lắng;
- Máy chiết tách ADN/ARN tự động (nếu có);
- Bộ điện di: khay đổ thạch, bể điện di, máy đọc và chụp ảnh gel.

Chu trình nhiệt để phát hiện virus gây bệnh herpesvirus trên cá chép bằng phương pháp PCR thực hiện ra sao? (Hình từ Internet)
Chu trình nhiệt để phát hiện virus gây bệnh herpesvirus trên cá chép bằng phương pháp PCR thực hiện ra sao?
Theo Mục C.2 Phục lục C Tiêu chuẩn quốc gia TCVN 8710-6:2019 về Bệnh thủy sản - Quy trình chẩn đoán - Phần 6: Bệnh do Koi herpesvirus ở cá chép quy định quy định về thành phần phản ứng và chu trình nhiệt như sau:
"C.2 Thành phần phản ứng và chu trình nhiệt
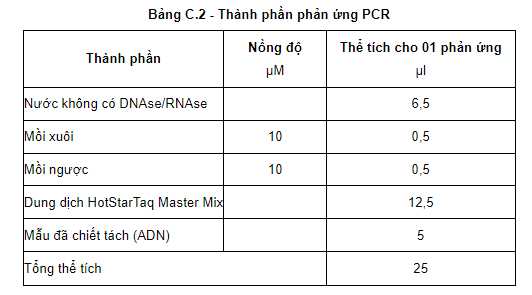
- Pha hỗn hợp nhân gen (master mix) theo hướng dẫn của nhà sản xuất bộ kít nhân gen PCR. Ví dụ sử dụng bộ kít Master mix HotstarTaq®Master Mix, Catalogue Number: 203445 của hãng Qiagen (thành phần bao gồm: HotStarTaq ADN Polymerase, PCR Buffer (với 3 mM MgCl2) và 400 μM dNTP).
- Tổng thể tích của phản ứng PCR là 25 μl (20 μl hỗn hợp Master mix và 5 μl mẫu ADN):
+ Cho 20 μl hỗn hợp Master mix vào ống PCR 0,2 ml.
+ Cho 5 μl ADN vừa tách chiết vào ống PCR 0,2 ml đã chứa sẵn 20 μl hỗn hợp Master mix.
LƯU Ý: Để kiểm soát phản ứng PCR, mẫu đối chứng âm và mẫu đối chứng dương được thực hiện song song cùng với mẫu kiểm tra.
+ Mẫu đối chứng âm: Cho 5 μl nước tinh khiết không có DNAse/RNAse vào ống PCR đã chứa sẵn 20 μl hỗn hợp Master mix.
+ Mẫu đối chứng dương: Cho 5 μl ADN dương chuẩn của vi rút KHV (mẫu ADN hỗn hợp được chuẩn bị từ mẫu dương chuẩn của vi rút KHV) vào ống PCR đã chứa sẵn 20 μl hỗn hợp Master mix.
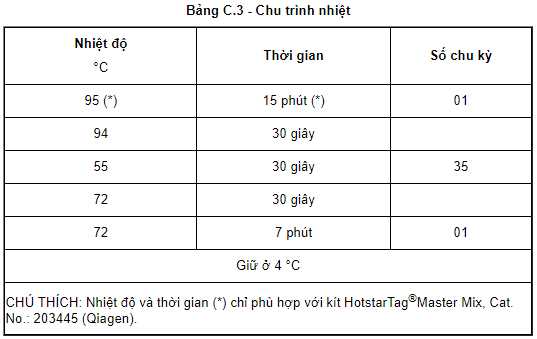
+ Đặt ống PCR (hỗn hợp Master mix và mẫu ADN) vào máy PCR và tiến hành cài đặt chu trình nhiệt thực hiện phản ứng PCR.
Theo đó, quá trình thực hiện chu trình nhiệt để phát hiện virus gây bệnh herpesvirus trên cá chép được thực hiện theo Tiêu chuẩn nêu trên.
Nhiệt độ và thời gian nêu trên chỉ phù hợp với kít HotstarTag®Master Mix, Cat. No.: 203445 (Qiagen).
Thực hiện điện di sản phẩm PCR để chẩn đoán bệnh herpesvirus trên cá chép nhiễm bệnh ra sao?
Theo Mục C.3 Phục lục C Tiêu chuẩn quốc gia TCVN 8710-6:2019 về Bệnh thủy sản - Quy trình chẩn đoán - Phần 6: Bệnh do Koi herpesvirus ở cá chép quy định quy định
"C.3 Điện di sản phẩm PCR
- Chuẩn bị thạch Agarose (3.2.4) 1,5 % pha trong dung dịch TBE (3.2.4) 0,5X bổ sung chất nhuộm gel (3.2.5) (ví dụ như: gel red) với tỷ lệ theo hướng dẫn của nhà sản xuất.
- Đổ thạch vào khuôn điện di (có lược).
- Thạch khô, rút lược ra và cho thạch vào bể điện di có chứa dung dịch TBE 1X.
- Cho mẫu vào các giếng (10 μl sản phẩm PCR + 2 μl dung dịch dung dịch nạp mẫu (3.2.6)).
- Sử dụng thang chuẩn ADN (100 bp) (3.2.7).
LƯU Ý: Khi chạy điện di sản phẩm PCR phải có mẫu đối chứng dương và đối chứng âm.
- Đậy nắp bể điện di lại và kết nối với dòng điện, phải đảm bảo dòng điện được kết nối đúng cực. Điện di trong vòng 45 phút với hiệu điện thế 80 V - 100 V.
- Sau khi điện di xong, tắt nguồn điện, lấy thạch ra rửa nước trong 5 phút và đọc kết quả bằng ánh sáng UV thích hợp, chụp ảnh."
Theo đó, để thực hiện điện di sản phẩn cần phải có thạch Agarose, dung dịch TBE, thạch khô và một số dụng cụ khác. Quy trình thực hiện áp dụng theo Tiêu chuẩn nêu trên.
Khi chạy điện di sản phẩm PCR phải có mẫu đối chứng dương và đối chứng âm.
Đậy nắp bể điện di lại và kết nối với dòng điện, phải đảm bảo dòng điện được kết nối đúng cực. Điện di trong vòng 45 phút với hiệu điện thế 80 V - 100 V.
Sau khi điện di xong, tắt nguồn điện, lấy thạch ra rửa nước trong 5 phút và đọc kết quả bằng ánh sáng UV thích hợp, chụp ảnh.
Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.